医師主導研究(臨床研究法)
重要なお知らせ(経過措置対象研究)
経過処置対象研究について
厚生局提出締切:平成31年3月18日(月)
法施行の際に実施されている特定臨床研究は、年度内にjRCTの公表等の手続きを完了するため、上記の期日までに地方厚生局に実施計画を提出する必要があります。
参考:「平成30年度末における施行前臨床研究に係る実施計画の提出について」(平成30年11月13日厚生労働省医政局研究開発振興課事務連絡)
経過措置について①
- 臨床研究法の円滑な施行に向け、新たに始める臨床研究や既に実施されている臨床研究について以下の措置を設ける。
① 施行日前の認定臨床研究審査委員会での実施計画の審査
② 法施行前から実施している継続研究の経過措置期間における審査
① 施行日前の認定臨床研究審 委員会での実施計画の審
施行日前に臨床研究審査委員会の認定申請を行うことができ、施行日前に認定を受けることができる(施行日に認定されたものとみなす。)。
施行日前に認定申請をし、認定を受けた上で、施行日前に、実施計画の審査を行い、施行日以降に認定臨床研究審査委員会として計画を承認する。
⇒ 施行日前からの実施計画の審査が可能。
<臨床研究法附則>
第五条 第二十三条第一項の認定を受けようとする者は、施行日前においても、同条第二項及び第三項の規定の例により、その認定の申請をすることができる。
2 厚生労働大臣は、前項の規定により第二十三条第一項の認定の申請があった場合においては、施行日前においても、同条第四項及び第二十四条の規定の例により、その認定をすることができる。この場合において、その認定は施行日において厚生労働大臣が行った第二十三条第一項の認定とみなす。
経過措置について②
- ②法施行前から実施している継続研究の経過措置期間における審査
-
- 研究の認定臨床研究審査委員会での再審査事項
- 人を対象とした医学系研究に関する倫理指針等に基づく倫理審査委員会の承認を得て実施している研究について、
臨床研究法の施行後に再度確認すべき事項は以下のとおり。また、審査については書類による審査でも構わない。
①研究の参加に関する事項(研究対象者の選択基準、インフォームド・コンセント)
②研究対象者の保護に関する事項(研究対象者に対する治療、安全性の評価、倫理的配慮)
③臨床研究の品質管理及び品質保証に関する事項
④臨床研究の実施体制、統計解析に関する事項、利益相反管理
-
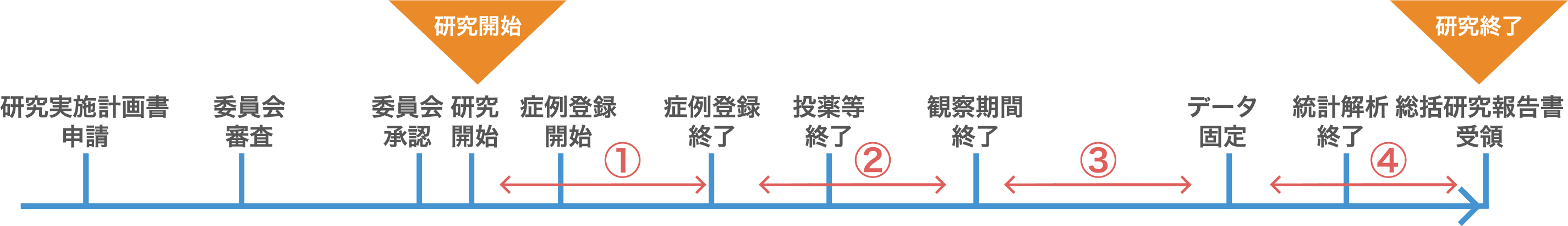
- 研究開始 ~ 症例登録終了
- 研究の開始から研究に参加する全ての研究対象者が決定(症例登録終了)するまでの間については、上記①~④全ての事項について認定臨床研究審査委員会での再確認が必要。
-
- 症例登録終了 ~ 観察期間終了まで
- 症例登録終了した研究については、新たな研究対象者に同意取得し研究に加えることがないため、①に関する事項の確認は意味をなさないため、②~④の事項について認定臨床研究審査委員会で再確認を行う。
-
- 観察期間終了 ~ データ固定まで
- 観察期間が終了した研究については、研究対象者に関する医療行為が終了しているため、②に関する事項の確認は意味をなさないため、③~④の事項について認定臨床研究審査委員会で再確認を行う。
-
- データ固定 ~ 研究終了(総括報告書を委員会が受理した時)
- データ固定が終了した研究については、既にモニタリング、監査が終了しているため、③に関する事項の確認は意味をなさないため④の事項について認定臨床研究審査委員会で再確認を行う
※ 法施行前から継続して実施される臨床研究については、経過措置期間中(特定臨床研究については認定倫理審査委員会の審査を受け厚生労働大臣に計画を提出するまでの間)、法が適用されていない事項については、従来どおり人を対象とする医学系研究に関する倫理指針を遵守することとする。
経過措置について③
| 実施計画の記載事項 審 項目 | ①の期間 | ②の期間 | ③の期間 | ④の期間 |
|---|---|---|---|---|
| 臨床研究実施体制 | ○ | ○ | ○ | ○ |
| 臨床研究実施計画の背景と根拠 | - | - | - | - |
| 臨床研究の目的 | - | - | - | - |
| 臨床研究のデザイン | - | - | - | - |
| 臨床研究の対象者の選択基準等 | ○ | - | - | - |
| 臨床研究の対象者に対する治療 | ○ | ○ | - | - |
| 有効性の評価 | - | - | - | - |
| 安全性の評価 | ○ | ○ | - | - |
| 統計解析 | ○ | ○ | ○ | ○ |
| 臨床研究の品質管理及び品質保証 | ○ | ○ | ○ | - |
| 倫理的配慮 | ○ | ○ | - | - |
| データの取扱い及び記録の保存 | - | - | - | - |
| 補償及び医療の提供 | - | - | - | - |
| 研究期間 | ○ | - | - | - |
| 利益相反管理 | ○ | ○ | ○ | ○ |
| インフォームド・コンセント | ○ | - | - | - |
※ 人を対象とした医学系研究に関する倫理指針等に基づく倫理審査委員会の承認を得て実施している研究について、臨床研究法の施行後に再度確認すべき事項の整理。また、審査については書類による審査でも構わない。
経過措置について④
【参考:継続研究の認定臨床研究審査委員会での再審査事項】
- ①
- ・研究の参加に関する事項
(研究対象者の選択基準、インフォームド・コンセント)
- ②
- ・研究対象者の保護に関する事項
(研究対象者に対する治療、安全性の評価、倫理的配慮)
- ③
- ・臨床研究の品質管理及び品質保証に関する事項
- ④
- ・臨床研究の実施体制
・統計解析に関する事項
・利益相反管理
CRB申請~法移行完了までの流れ
| 1 | 研究倫理審査申請システムに新規登録 | 臨床研究法移行に伴い、整理番号を新たに発番するためシステム登録 |
|---|
↓
| 2 | 申請書類をシステムにアップロード | 申請資料をシステムに順次アップロード 利益相反は利益相反アドバイザリー室へ相談 (利益相反アドバイザリー室):coioffice@m.u-tokyo.ac.jp |
|---|
↓
| 3 | 申請書類の修正 【CRB審査日 4~6W前~】 【CRB審査日 3W前の(木)迄にFix】 |
臨床研究推進センターと研究倫理支援室にて書類を確認 確認結果によって書類修正 |
|---|
↓
| 4 | CRB委員事前審査の対応 【CRB審査日 約2W前~】 |
書類確認後に、CRB委員による事前確認 システム内にて質疑応答対応 |
|---|
↓
| 5 | CRB審査 (対面審査・書面審査) 審査日:12/25、1/28、2/26 |
対面審査の場合は、研究責任医師(代理可)CRB出席必要 審査結果:「承認」 「継続審査」⇒次回CRBもしくは「簡便な審査」⇒「承認」 |
|---|
↓
| 6 | CRB審査後の修正 | CRBでの指摘事項に対応 |
|---|
↓
| 7 | CRB結果通知(承認) 【CRB審査日から2~3W後】 |
CRB事務局が審査結果をメールで研究責任医師に通知します。 |
|---|
↓
| 8 | 病院長の実施許可の取得 【CRB審査日から3W後】 |
実施許可願書と実施体制の確認書類を提出 1W以内には病院長承認通知発行 |
|---|
↓
| 9 | jRCTの登録・地方厚生局へ提出(郵送)
【CRB審査日から4W後】 期限:2019年3月18日(月)厳守 |
研究情報(CRBが承認した実施計画)を、jRCT(Web)に登録後、jRCTに登録した情報を紙媒体で地方厚生局へ郵送 |
|---|
↓
| 10 | jRCTで研究計画が公開 臨床研究法への移行完了 期限:2019年3月31日(日)厳守 |
研究計画が公開されるまでは、現介入等委員会で対応(例:SAE報告等) 研究究倫理支援室に対して現介入等研究の終了届けを提出 |
|---|
<問い合わせ先>
臨床研究施設事務局
TEL:03-5800-8743
内線:34290
e-mail:CReSjimu-tokyo@umin.ac.jp
